
近年来,随着纳米技术的飞速发展,以纳米材料为载体的纳米药物逐渐成为生物医药领域的前沿热点之一,为癌症诊疗提供了新的思路和希望。然而,目前绝大多数纳米材料不具备生物可降解性并且易被网状内皮系统捕获,导致其在肝脏和脾脏等器官中蓄积,从而难以排出体外。体内长期滞留而产生的潜在毒性是阻碍纳米材料从基础研究向临床试验转化的难题。如何构建兼具肿瘤靶向蓄积且快速代谢的生物友好型纳米药物,实现肿瘤靶点安全有效的精准治疗,是当前肿瘤诊疗研究面临的一项重大挑战。
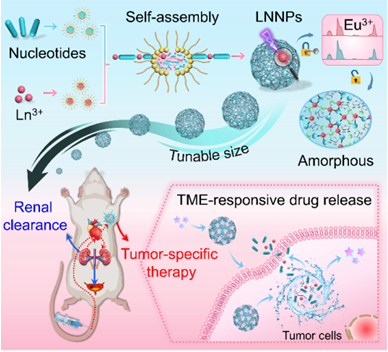
图1、稀土-核苷酸自组装纳米颗粒(LNNPs)的胶束模板法制备及肿瘤微环境响应的药物递送策略示意图。
针对该问题,中科院功能纳米结构设计与组装/福建省纳米材料重点实验室陈学元团队利用稀土离子和生物分子核苷酸(三磷酸腺苷,ATP)的自组装成功构建了一种肿瘤微环境响应型可生物降解的有机-无机杂化纳米药物并实现了肿瘤的无毒精准治疗。该纳米药物具备优异的生物相容性、良好的肿瘤靶向蓄积能力和肿瘤靶点特异性释药性能,同时可以通过肾清除的方式有效代谢并排出体外,在保证肿瘤治疗效果的同时,有效避免了纳米材料潜在的毒性问题(图1)。
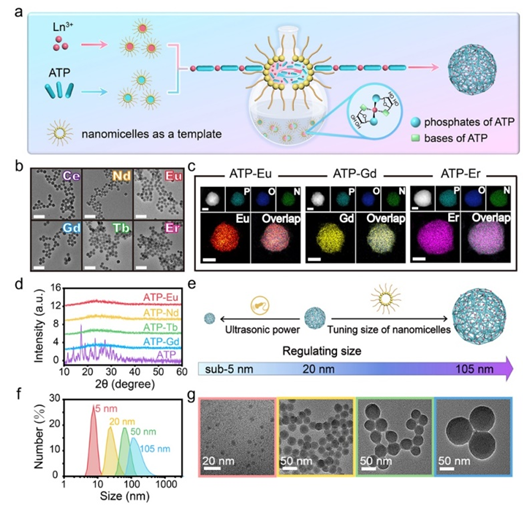
图2、(a)以纳米胶束为模板合成LNNPs的示意图;(b)用不同稀土离子合成的LNNPs透射电镜图。图中标尺均为100nm;(c)用不同稀土离子合成的LNNPs扫描透射电镜图及其相应的元素分布。图中标尺均为10nm;(d)ATP和含不同稀土离子LNNPs的X射线衍射图谱;(e)LNNPs的粒径精准调控示意图;(f)不同尺寸LNNPs的水合粒径分布图和(g)透射电镜图。
团队借助纳米胶束模板法,开发了一种新型且普适的稀土-核苷酸自组装纳米颗粒(LNNPs)可控制备方法,获取的LNNPs单分散性好,粒径可控(4.6-105.7nm),且具备疏松多孔的非晶态结构(图2)。该材料展示出优异的生物相容性、高药物负载率和肿瘤微环境特异性响应等性能。基于肿瘤微环境具有弱酸性(pH 6.5~7.2)、富含活性氧(如O2·-、H2O2和·OH)等特点,团队选取生物利用度高的超小LNNPs(<5 nm)用于模型化疗药物阿霉素(DOX)的负载和抗肿瘤研究(图3)。结果显示,该类纳米药物(DOX@LNNPs)的血液循环半衰期(3.3h)明显优于传统肾脏可清除纳米材料(t1/2< 2 h),尾静脉注射12 h后肿瘤部位的纳米药物含量达到9.42% ID/g,可以在肿瘤微环境特异性降解并于肿瘤靶点有效释放药物。同时,未被肿瘤捕获的DOX@LNNPs可通过肾代谢路径24h内排出体外,显著降低了纳米材料的体内蓄积时间和长期毒性。器官病理与血液生化分析结果表明,DOX@LNNPs对治疗组小鼠没有产生急性毒性和其他毒副作用,实现了肿瘤部位的精准无毒治疗。
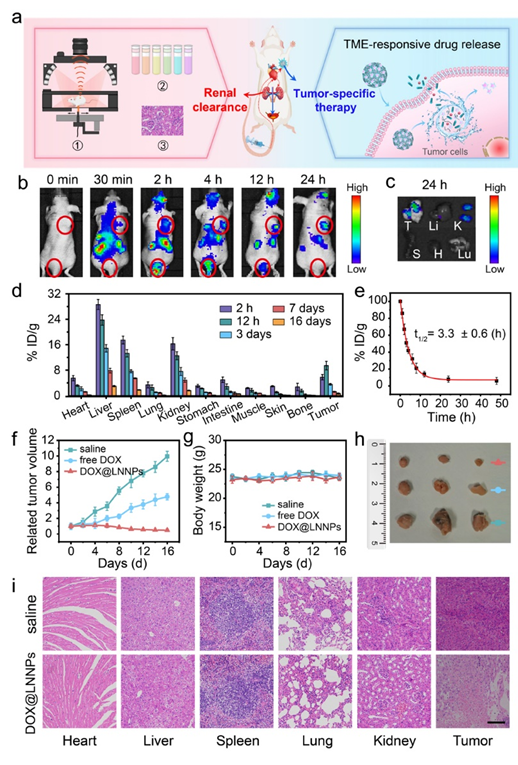
图3、(a)兼具肾脏清除能力和肿瘤微环境响应可生物降解特性的DOX@LNNPs用于精准的肿瘤治疗示意图;(b)尾静脉注射DOX@LNNPs后不同时间下MCF-7乳腺癌荷瘤小鼠的荧光图像。图中位于上方和下方的红圈分别代表了肿瘤和膀胱区域;(c)注射24h后收集的离体器官和肿瘤的荧光图像(T:肿瘤,Li:肝,K:肾,S:脾,H:心,Lu:肺);(d)DOX@LNNPs在荷瘤小鼠体内的生物分布;(e)DOX@LNNPs在荷瘤小鼠体内的血液循环时间;(f)分别经生理盐水、游离 DOX 和DOX@LNNPs处理的小鼠肿瘤生长曲线;(g)不同处理组的小鼠体重变化;(h)从小鼠体内分离出的肿瘤的照片;(i)在第16天采集的小鼠主要器官和肿瘤的组织学图像。图中标尺均为100μm。
该研究不仅发展了一种构建无机-有机杂化纳米药物的新方法,而且为肿瘤的精准治疗提供了新思路,将促进稀土纳米药物临床试验的转移转化。相关结果以研究论文形式发表于《德国应用化学》杂志(Angew. Chem. Int. Ed.2022, 61, e202116983),并被选为热点论文。文章的第一作者是中国科学院大学博士研究生杨颖婕,通讯作者是刘龑副研究员和陈学元研究员。
此前,陈学元团队在肿瘤诊疗纳米药物和稀土荧光生物探针的设计、合成及应用中已取得了一系列重要进展。例如,基于稀土纳米探针实现了全血中循环肿瘤细胞直接检测(Angew. Chem. Int. Ed.2019, 58, 12195);设计了用于肿瘤靶向发光示踪的氧化石墨烯修饰稀土纳米探针(Angew. Chem. Int. Ed.2019, 58, 18981);通过稀土纳米荧光探针实现了唾液中肿瘤标志物即时检测(Adv. Sci.2021, 8, 2002657);发展了基于稀土上转换纳米平台的光动力联合溶菌酶抗菌疗法(Angew. Chem. Int. Ed.2021,60, 19201)。
Powered By 浙磁协门户网 版权所有 © 2015-2024, All right reserved. 浙ICP备2021010281号-1 浙公网安备 33078302100930号